El Plan de Abordaje de las Terapias Avanzadas en el Sistema Nacional de Salud (SNS) ha cumplido recientemente cuatro años desde su puesta en marcha en España en noviembre de 2018, y prácticamente el mismo tiempo desde que se financiara, apenas un mes después, la primera CAR-T en el Sistema Nacional de Salud (SNS).
Ahora bien, la “revolución” clínica, y reciente, que han protagonizado las CAR-T en el abordaje de las enfermedades oncohematológicas es fruto de más de 60 años de investigación
Para encontrar el origen que sentaron las bases en el desarrollo de la terapia CAR-T hay que tirar de hemeroteca y retroceder a la década de los 50’ del siglo pasado. El descubrimiento del trasplante de médula ósea fue la primera vez que se infundieron células vivas en pacientes con cáncer de la sangre.
Sin embargo, fue en 1987 cuando se creó el primer receptor de antígeno quimérico (CAR). En las fases siguientes, el ADN que codifica para este receptor se implantó en células T para crear células CAR-T y a finales de la década de los 90’ se desarrollaron los primeros métodos para multiplicar las células CAR-T en el laboratorio e infundirlas para que pudiesen actuar encontrando y destruyendo a las células cancerosas.
No sería hasta 2011 cuando se anunciaron los primeros resultados prometedores que mostraban una remisión completa de pacientes con leucemia linfocítica crónica (LLC).
Las células CAR-T son células inmunes diseñadas artificialmente para expresar un receptor de antígeno quimérico particular (CAR), que han demostrado un gran potencial para matar células cancerosas. Los receptores de antígenos quiméricos (CAR) son receptores recombinantes producidos artificialmente que tienen tanto potencial de unión a antígeno como de activación de células T.
Primeras aprobaciones
En julio de 2018, las primeras terapias de células T con CAR de fabricación industrial llegaron a Europa. Kymriah (tisagenlecleucel), de Novartis, indicado para el tratamiento de la leucemia linfoblástica aguda (LLA) y para el linfoma difuso de células B grandes (DLBCL); y Yescarta (axicabtagene ciloleucel), de Gilead, para el tratamiento del linfoma difuso de células B grandes (DLBCL), se convirtieron en las primeras terapias CAR-T aprobadas por la Agencia Europea del medicamento (EMA). Para su disponibilidad en España hubo que esperar unos meses más: Kymriah lo hizo en diciembre de 2018 y Yescarta en julio de 2019.
Durante estos cuatro años, el diseño de las células CAR-T ha evolucionado continuamente con la incorporación de enfoques nuevos a lo largo del tiempo. Actualmente, se está trabajando ya en las CAR-T de cuarta generación.
Atendiendo al contexto español, la Agencia Española del Medicamento (Aemps) autorizó en febrero de 2021 el primer CAR-T de fabricación no industrial (ARI-0001) y el 1 de junio de 2021 fue incluido en la prestación farmacéutica del SNS. ARI-0001 fue desarrollada íntegramente en el Hospital Clínic de Barcelona para tratar a pacientes con LLC de más de 25 años. Esta autorización supuso un hito al ser el primer tratamiento con células genéticamente modificadas que lo logra en nuestro país. Además, es el primer CAR-T desarrollado íntegramente en Europa que es aprobado por una agencia reguladora. Cabe recordar que el propio Plan Nacional de Terapias Avanzadas contempla como uno de sus objetivos un mayor apoyo progresivo en las terapias académicas frente a la dependencia de la fabricación industrial.
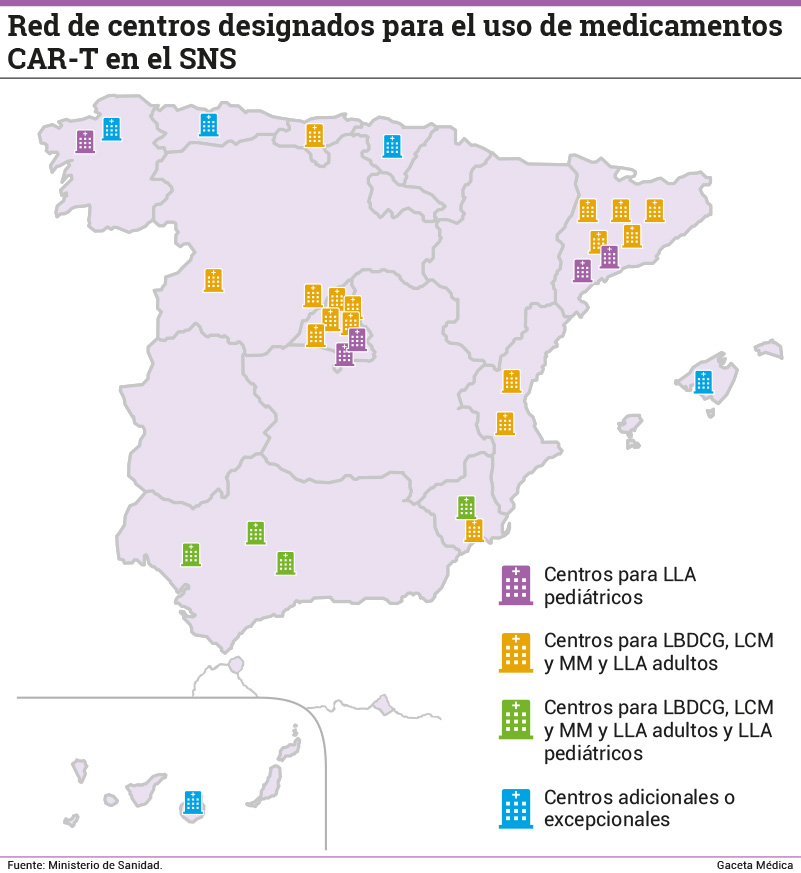
Respecto a los denominados “centros de referencia”, actualmente, son 30 los centros designados en España para la administración de los tratamientos con CAR-T en la lucha contra enfermedades oncohematológicas. Al grupo inicial de 16 centros con los que arrancó el Plan Nacional se sumaron otros 14 en junio de 2022, para una mayor cobertura geográfica.
Balance a los tres años de terapias CAR-T: último informe publicado por el Ministerio de Sanidad en junio de 2022 (periodo de análisis: del 8 de marzo de 2019 hasta el 1 de marzo de 2022
- Se han realizado 768 solicitudes para el tratamiento de pacientes con medicamentos CAR-T, procedentes de 17 CC. AA. y 138 hospitales.
- Las CC. AA. que ha realizado el mayor número de solicitudes es Cataluña con un 18% del total de peticiones, seguida por Andalucía (16%), Madrid (15%), Comunidad Valenciana (10%), Castilla y León (7%) y Galicia (6%).
- El 80,47% de las solicitudes se realizaron para pacientes con diagnóstico de linfoma, siendo para pacientes con LLA-B el 19,53%.
- La valoración final fue favorable en el 91,33% de las solicitudes para pacientes con LLA-B, siendo en el caso de linfoma favorable en el 89%de las solicitudes.
- Se dispone de datos de resultados de la administración de tratamientos con CAR-T en 300 pacientes: el 45% (134) fallecieron, el 24% (72) progresaron precozmente y el 26% (78) presentaron respuesta completa.
Centros de referencia
El 100% de los centros designados para el tratamiento de LBDCG y de LLA están cualificados bien para un medicamento o para ambos.
Por ejemplo, el reciente galardonado con el Premio BiC a la Mejor Unidad de Referencia en Terapias Celulares CAR-T, el Hospital Universitario Virgen del Rocío de Sevilla, cuenta con un largo recorrido en tratamientos con CAR-T: en 2021 realizó un total de 47 tratamientos y 24 de ellos correspondieron a adultos comerciales, seis infantiles comerciales y 17 en adultos a través de ensayos clínicos. Asimismo, el último hito alcanzado por este hospital fue la fabricación de T-CAR19, tras la autorización de Aemps. Con la producción de CAR-T académicas, el centro podrá tratar a pacientes con Linfoma no-Hodgkin B en el marco de ensayos clínicos.
Siguiendo la estela de centros de referencia, que además han quedado finalistas en los Premios BiC 2022, el Hospital Universitari Vall d’Hebron de Barcelona dispone de experiencia con siete constructos distintos (axi- cel, tisa-cel, brexu-cel, liso-cel, cilta-cel, Auto-1, Auto-4) empleados en pacientes con diferentes neoplasias hematológicas. Desde el año 2018 se han tratado en la unidad 259 pacientes (67 de ellos en el año 2021), 71 pacientes en ensayo clínico y 188 comerciales.
Por su parte, la Unidad de Terapias Avanzadas CAR-T del Hospital General Universitario Gregorio Marañón (Madrid) se define como una unidad multidisciplinar y de alta especialización que tiene como objetivo la coordinación, seguimiento y evaluación de resultados del programa de terapia celular hematológica de células inmunoefectoras quiméricas. Haciendo balance de su actividad, ha tratado un total de 102 pacientes con CAR-T hasta mediados de octubre del año pasado. Dos de ellos como uso compasivo, 10 dentro de ensayos clínicos y 90 con tratamiento comercial, de los cuales nueve abordaban LLA y 93 linfomas no Hodgkin.
Siguiendo esta línea, el también madrileño Hospital Infantil Universitario Niño Jesús cuenta con amplia experiencia en los procesos de procesamiento celular y aféresis. Además de la experiencia clínica con CAR-T acreditada y documentada durante el proceso de evaluación de centros, el hospital ha incrementado su experiencia clínica en la indicación, administración y seguimiento de CAR-T en niños y adolescentes con LLA, desde su fecha de designación como centro autorizado. Uno de sus hitos principales tiene que ver con la primera solicitud para aprobación de tratamiento de Kymriah.
Asimismo, además de administrar las terapias autorizadas, el Servicio de Hematología y Hemoterapia del Hospital de la Santa Creu i Sant Pau (Barcelona) participa actualmente en los ensayos clínicos con las terapias de Novartis y Janssen, como el ensayo fase III tres con Cartitude-5 para mieloma múltiple. De igual modo, el servicio participa en ensayos clínicos académicos de inmunoterapia con linfocitos T modificados genéticamente para dos tipos de linfomas y de inmunoterapia con linfocitos T de memoria, seleccionados mediante la expresión de CD62L en linfoma no Hodgkin.
También el equipo del Servicio de Hematología y Hemoterapia del Hospital Universitario 12 de Octubre (Madrid) presenta una gran trayectoria en investigación en este campo. Por ejemplo, dispone de experiencia preclínica con células inmunoefectoras. Forma parte como grupo estable a la red TERCEL de terapia celular y han conseguido cinco proyectos de investigación en convocatorias competitivas. Además, participan en otro de ellos como grupo colaborador y cuentan con experiencia en la manipulación de células CART y NK CAR. Asimismo, el equipo dispone de capacidad para diseñar nuevos CAR y manipular mediante CRISP-CAS9 las células inmunoefectoras.
Por su parte, hasta la fecha el Servicio de Hematología y Hemoterapia del Hospital Universitario de Gran Canaria Dr. Negrín ha tratado un total de 13 pacientes con la CAR-T Yescarta. Junto con el Hospital Son Espases, en Palma de Mallorca, se trata del único centro en territorio no peninsular aprobado para la administración de terapia CAR-T, de ahí la importancia de su actividad para garantizar el acceso a estas terapias a los pacientes canarios. En cuanto al número de ensayos clínicos o proyectos de investigación realizados o en marcha con terapias CAR-T, colaboran con el Hospital Clinic de Barcelona en el ensayo ARI0001 para el tratamiento de pacientes canarios con LLA, y ARI0002 para pacientes con MM, además del ensayo PHE885 de Novartis para pacientes con MM.
La Unidad coordinada de Investigación Traslacional y de Terapias Avanzadas en Inmuno-Hemato-Onco Infantil del Hospital Universitario La Paz de Madrid cuenta desde julio con la autorización de fabricación no industrial para células NKAE y células CART19/22. Por su parte, desde marzo de 2019 es uno de los dos centros de referencia pediátrico para la administración de CAR-T. En el contexto de las terapias avanzadas, dentro de la clasificación de inmunoterapias celulares, la principal fortaleza es el desarrollo de dos tipos de inmunoterapias basadas en células: células NK activadas y expandidas (NKAE), con cuatro ensayos clínicos y tres más a la vista. Junto a este logro, el centro ha desarrollado dos CAR-T académicos cuyos resultados se materializan en el CART45RA-NKG2D, protagonista de dos ensayos clínicos en leucemias y tumores cerebrales.