Un grupo de investigadores del Ciber en la Universidad de Zaragoza y en el Instituto de Investigación Germans Trial i Pujol han demostrado la efectividad in-vitro del uso de nanopartículas de ácido poliláctico-co-glicólico (PLGA) cargadas de rifampicina para tratar la tuberculosis.
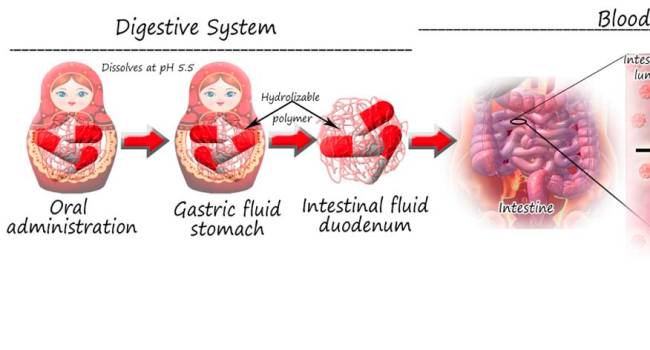
Los investigadores han encapsulado el antibiótico en nanopartículas, que a su vez han sido encapsuladas en macropartículas tipo ‘Matrioskas’, resistentes al pH ácido del estómago. De esta forma, las micropartículas se podrían administrar de forma oral, resistir la degradación gástrica y alcanzar el intestino.
“La principal novedad es que hemos mejorado la manera de aplicar el antibiótico ya que sabemos en su administración un 26 por ciento se degrada en el estómago”, destaca a GM Manuel Arruebo Gordo, investigador del grupo del Ciber de Bioingeniería, Biomateriales y Nanomedicina (Ciber-BNN) de la Universidad de Zaragoza.
Una vez en el intestino, se liberarían las nanopartículas de PLGA cargadas del fármaco anti-tuberculosis y cruzarían la pared intestinal para poder alcanzar la circulación sistémica y potencialmente los macrófagos alveolares infectados por el patógeno intracelular, co-localizando las nanopartículas cargadas de antibiótico con el agente patógeno.
Según la investigación, estas nanopartículas fueron capaces de migrar por una membrana epitelial in-vitro que mimetiza la pared intestinal y así poder cumplir con su función de transporte y liberación controlada del fármaco encapsulado, que de esta manera evita el contacto con enzimas digestivas y con el bajo pH.
Uso más racional
“La tuberculosis es un patógeno intracelular que coloniza nuestros alveolos pulmonares y por eso es tan difícil tratarla. Hay que darle al paciente cuatro meses de tratamiento antibiótico ya que tiene llegar hasta dentro de nuestras propias células y atacar a la microbacteria que vive dentro de las células”, explica el investigador para incidir en que la importancia de este estudio radica en que “tratamos de mejorar farmacocinética de un antibiótico bien conocido” lo que supondría “reducir, hipotéticamente, un tratamiento que hoy en día se extiende entre cuatro y seis meses ya que se haría un uso mas racional del antibiótico”, añade.
Este estudio sienta las bases para futuras investigaciones basadas en nanopartículas, orientadas a la evaluación in-vivo de esas nanopartículas con antibióticos en ratones infectados con tuberculosis.
“En un experimento in-vivo con animales pensamos que las células fagocitarán y se comerán a las nanopartículas. Al suceder esto introducirían en su interior el antibiótico que contienen estás para que co-localice el patógeno con la microbacteria”, concluye.
Este estudio se ha llevado a cabo gracias al proyecto Tarmac, financiado por una iniciativa del Ciber de Bioingeniería, Biomateriales y Nanomedicina (Ciber-BBN), del Ciber de Enfermedades Respiratorias (Ciberes) y de la Sociedad Española de Neumología y Cirugía Torácica (Separ).
Un grupo de investigadores del Ciber en la Universidad de Zaragoza y en el Instituto de Investigación Germans Trial i Pujol han demostrado la efectividad in-vitro del uso de nanopartículas de ácido poliláctico-co-glicólico (PLGA) cargadas de rifampicina para tratar la tuberculosis.
Los investigadores han encapsulado el antibiótico en nanopartículas, que a su vez han sido encapsuladas en macropartículas tipo ‘Matrioskas’, resistentes al pH ácido del estómago. De esta forma, las micropartículas se podrían administrar de forma oral, resistir la degradación gástrica y alcanzar el intestino.
“La principal novedad es que hemos mejorado la manera de aplicar el antibiótico ya que sabemos en su administración un 26 por ciento se degrada en el estómago”, destaca a GM Manuel Arruebo Gordo, investigador del grupo del Ciber de Bioingeniería, Biomateriales y Nanomedicina (Ciber-BNN) de la Universidad de Zaragoza.
Una vez en el intestino, se liberarían las nanopartículas de PLGA cargadas del fármaco anti-tuberculosis y cruzarían la pared intestinal para poder alcanzar la circulación sistémica y potencialmente los macrófagos alveolares infectados por el patógeno intracelular, co-localizando las nanopartículas cargadas de antibiótico con el agente patógeno.
Según la investigación, estas nanopartículas fueron capaces de migrar por una membrana epitelial in-vitro que mimetiza la pared intestinal y así poder cumplir con su función de transporte y liberación controlada del fármaco encapsulado, que de esta manera evita el contacto con enzimas digestivas y con el bajo pH.
Uso más racional
“La tuberculosis es un patógeno intracelular que coloniza nuestros alveolos pulmonares y por eso es tan difícil tratarla. Hay que darle al paciente cuatro meses de tratamiento antibiótico ya que tiene llegar hasta dentro de nuestras propias células y atacar a la microbacteria que vive dentro de las células”, explica el investigador para incidir en que la importancia de este estudio radica en que “tratamos de mejorar farmacocinética de un antibiótico bien conocido” lo que supondría “reducir, hipotéticamente, un tratamiento que hoy en día se extiende entre cuatro y seis meses ya que se haría un uso mas racional del antibiótico”, añade.
Este estudio sienta las bases para futuras investigaciones basadas en nanopartículas, orientadas a la evaluación in-vivo de esas nanopartículas con antibióticos en ratones infectados con tuberculosis.
“En un experimento in-vivo con animales pensamos que las células fagocitarán y se comerán a las nanopartículas. Al suceder esto introducirían en su interior el antibiótico que contienen estás para que co-localice el patógeno con la microbacteria”, concluye.
Este estudio se ha llevado a cabo gracias al proyecto Tarmac, financiado por una iniciativa del Ciber de Bioingeniería, Biomateriales y Nanomedicina (Ciber-BBN), del Ciber de Enfermedades Respiratorias (Ciberes) y de la Sociedad Española de Neumología y Cirugía Torácica (Separ).
Al alcanzar el intestino
Liberarían las nanopartículas de PLGA cargadas del fármaco anti-tuberculosis y cruzarían la pared intestinal
En la cirulcación
Alcanzarían los macrófagos alveolares infectados por el patógeno intracelular, co-localizando el patógeno