br
El impacto de la sanidad transfronteriza es limitado, ya que, según Bruselas, no supera el 1 por ciento del gasto sanitario europeo total. Dentro de ella, las estimaciones que se manejan es que la prescripción de medicamentos y productos sanitarios entre Estados miembro supone el 0,08 por ciento de los gastos sanitarios públicos. Si se tiene en cuenta que los estados gastaron más de 900.000 millones de euros en Sanidad en 2010, el impacto financiero de las prescripciones transfronterizas superaría los 750 millones de euros.
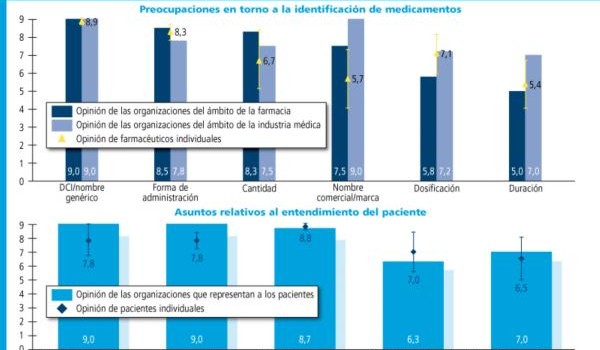
La encuesta online lanzada desde Bruselas recibió 81 respuestas en toda la UE. Médicos y farmacéuticos insisten fundamentalmente en la necesidad de verificar y validar las prescripciones foráneas. Ello supone identificar a la perfección, no solamente el propio medicamento, sino también al paciente y al médico.
En este sentido, la patronal europea de farmacéuticos, la PGEU, denuncia la actividad de los “doctores virtuales” en países como Reino Unido y Países Bajos, que permiten prescribir por Internet los denominados ‘fármacos para el estilo de vida’, como los destinados a combatir la disfunción eréctil, a ciudadanos de otros países únicamente con rellenar un cuestionario en Internet. Para la patronal europea, aquellos países en los que las “prescripciones por Internet” son ilegales no deberían ser obligados a aceptarlas.
El 25 de octubre de 2012 finaliza el plazo otorgado por la Comisión Europea para dotar de contenido el artículo 11 de la directiva de Sanidad Transfronteriza y aclarar el marco sobre el que se debe desarrollar el objetivo del reconocimiento mutuo de las recetas. Las respuestas a la consulta lanzada a tal efecto, que finalizó a principios de enero, ha confirmado que adoptar un sistema europeo de prescripción no será fácil, no tanto por la necesidad de verificar y validar las prescripciones foráneas (algo que puede tantos costes añadidos como beneficios) como por la variabilidad de los sistemas de prescripción. El debate de la prescripción transfronteriza ha derivado, de nuevo, en el debate de la prescripción por principio activo.
En su día, la Organización Médica Colegial remitió sus valoraciones sobre este tema en la consulta electrónica formulada por la Unión Europea sobre el reconocimiento mutuo de recetas. En opinión de su presidente, Juan José Rodríguez Sendín, cada prescripción debería llevar necesariamente un único identificador, que corresponde a un médico, con independencia de que sea en formato electrónico o papel. De este modo, se ayudaría a la verificación del facultativo, al igual que con la creación de bases de datos federadas de los registros nacionales.
De cara a la identificación del paciente, la OMC aboga por incluir referencias como el pasaporte, DNI o número de la seguridad social. Para el presidente de la organización médica es preciso resolver los problemas de bioapariencia de los fármacos incluidos en grupos homogéneos, así como asegurarse de que el paciente reconoce el medicamento y entiende totalmente sus instrucciones de uso.
Según las aportaciones remitidas a la UE, el elemento que podría causar más problemas en la dispensación de prescripciones transfronterizas son los excipientes de cada principio activo, un elemento que, al igual que la bioapariencia, debería quedar contemplado en la norma.
Pauta de prescripción
¿Cómo deberán prescribir los médicos europeos cuando la dispensación vaya a hacerse en otro estado miembro? El hecho de que Bruselas considere la necesidad de incluir en las recetas una denominación común internacional (DCI) ha puesto en alerta al sector innovador en Europa.
La sustitución no siempre es posible. Es el mensaje que patronales y compañías se esfuerzan por trasladar en forma de línea roja a los fármacos biológicos. Debido a su variabilidad, y para asegurar que los productos se entregan de acuerdo con las necesidades médicas de los pacientes, estos fármacos deberían prescribirse únicamente por marca, no por DCI.
Así lo aseguran la Federación de Asociaciones de la Industria Farmacéutica (Efpia); la Asociación de Empresas Biofarmacéuticas (EBE); la Asociación de Bioindustrias (EuropaBio) y compañías como Roche o Abbott. Su oposición a que se obligara a prescribir por DCI en estos casos va unida también a una petición común: la de que junto al principio activo vaya acompañada la marca comercial.
Todos comparten las mismas motivaciones: en el caso de los fármacos biológicos, original y biosimilar tienen un principio activo similar, y de hecho a menudo comparten la denominación común internacional. No obstante, a diferencia de los genéricos, los biosimilares “no son idénticos, sino solo similares a su producto de referencia”. De ahí que sea crítico, dicen, que la sustitución de un biológico por un biosimilar sólo tenga lugar con el conocimiento del médico.
Parecidos, pero no idénticos
Lo mismo debe aplicarse, desde su punto de vista, a diferentes biosimilares que se refieren a un mismo original. Ambos serán parecidos entre sí, pero no idénticos, lo que suma un nuevo motivo a su argumentario: sin una identificación clara del producto, el seguimiento de la farmacovigilancia podría verse muy comprometido.
Sin embargo, es el límite de esa línea roja no está claro. Efpia y EBE aseguran que existen otros supuestos en los que la sustitución por genérico “no está garantizada”, como en el caso de productos con un índice terapéutico limitado (como los antiepilépticos) o en casos en los que la elección del dispositivo es importante para lograr la adherencia del paciente. Ambas patronales optan por dejar la opción de si la sustitución es segura solo y exclusivamente al médico. En última instancia apuestan, como también hace la patronal europea de los farmacéuticos, la PGEU, por incluir un campo blanco que permita a los prescriptores recomendar una marca específica.
No obstante, la visión de la farmacia varía de los argumentos de la industria innovadora. La PGEU mantiene que la capacidad del médico de prescribir por marca debe mantenerse “solo en ciertas circunstancias” y resalta los daños que podría ocasionar una sustitución por marca si el producto no está disponible en el país que lo debe dispensar. A ello se suma la opinión de los consumidores. Una de las patronales que los agrupa, BEUC, cree importante incluir la prescripción por DCI para que el público se familiarice con el nombre del genérico.
Pero no sólo el sector está dividido, sino que las legislaciones nacionales son difíciles, por no decir imposibles, de cuadrar. “En España es obligatorio por el RDL 9/2011”, recuerda el CGCOF en sus comentarios. La única administración sanitaria española que envió comentarios a la consulta, el Servicio Andaluz de Salud (SAS), lo ratifica: “Sobre sustitución genérica, debe ser siempre ‘sí’, si la ley lo permite, y los médicos deben justificar se decisión contraria”, dice su subdirector de Farmacia, Antonio Peinado.
Los médicos españoles recalcan que hay que resolver la bioapariencia de los fármacos en grupos homogéneos
La sustitución de
un biológico por un biosimilar sólo se
debe realizar con el
aprobado del médico